我国学者在心肌缺血/再灌注损伤保护研究领域取得新进展
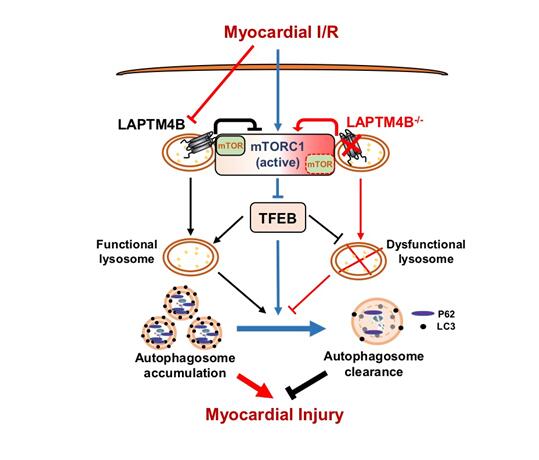
图. LAPTM4B通过调控mTORC1/TFEB信号维持溶酶体功能减轻心肌I/R损伤
在国家自然科学基金项目(批准号:81770402、81520108004)等资助下,中科院上海营养与健康研究所杨黄恬研究组与中山大学曹楠研究组合作,揭示了溶酶体膜蛋白在心肌缺血/再灌注损伤与保护中的重要作用和调控新机制。研究成果以“心肌缺血/再灌注损伤过程中LAPTM4B下调去除对mTORC1信号激活的抑制进而导致自噬流受阻(Downregulation of LAPTM4B Contributes to the Impairment of the Autophagic Flux via Unopposed Activation of mTORC1 Signaling during Myocardial Ischemia/Reperfusion Injury)”为题,于2020年7月23日在线发表在《循环研究》(Circulation Research)上,论文链接:https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.119.316388。
缺血性心肌病是危害我国国民健康的重大疾病之一,及时进行再灌注是挽救缺血心脏的必需步骤,然而该过程伴随着严重的心肌缺血/再灌注(I/R)损伤,临床仍缺乏有效的干预手段。近年研究发现,自噬这一关键细胞稳态维持系统在I/R损伤中扮演了重要角色。在心肌缺血阶段,激活的自噬可以清除诱发心肌细胞死亡的错误折叠蛋白和坏死线粒体等,从而起到心肌保护作用;而在再灌注阶段自噬水平处于过度激活状态,但形成的自噬小体清除障碍,往往对心肌造成损伤。为何自噬在I/R不同阶段具有相反的作用?其调控靶点和机制是什么?调控自噬小体清除的重要的溶酶体蛋白是什么?这些是领域内有待阐明的重要科学问题,亦是困扰自噬调控药物临床应用的重要障碍。
该研究团队利用小鼠心肌I/R模型,通过多学科研究手段发现:再灌注阶段心肌细胞中溶酶体的数量和功能明显下降,从而导致自噬流被部分阻断,心肌细胞对自噬小体的清除能力大为降低,过量自噬小体的堆积导致心肌细胞大量死亡同时伴随着溶酶体膜蛋白LAPTM4B水平的下调。进一步研究发现:LAPTM4B对溶酶体数量和功能的维持起关键作用。LAPTM4B
-/-小鼠I/R心肌溶酶体数量进一步减少、自噬小体堆积加重,心肌梗死面积加大;而LAPTM4B过表达可以逆转心肌I/R所导致的这些表型,但其心肌保护作用可被溶酶体功能抑制剂取消,提示LAPTM4B可通过提升I/R心肌溶酶体数量和功能减少自噬小体累积,进而发挥心肌保护作用。进一步分析发现,LAPTM4B可通过其E3区域与mTOR蛋白结合抑制I/R所引起的mTORC1复合物激活,进而促进溶酶体关键转录因子TFEB的核转位,从而协助溶酶体功能维持,提升心肌细胞抵抗I/R损伤的能力。
该研究不仅揭示了LAPTM4B在心脏的新功能和其调控的mTORC1/TFEB通路在心肌I/R导致的自噬中的重要作用,并提示维持溶酶体功能是对抗心肌I/R损伤的重要环节。
转自:国家自然科学基因委员会
原文链接:
http://www.nsfc.gov.cn/publish/portal0/tab448/info78345.htm