我国学者在神经元N-甲基-D-天冬氨酸受体调控机制研究方面取得进展
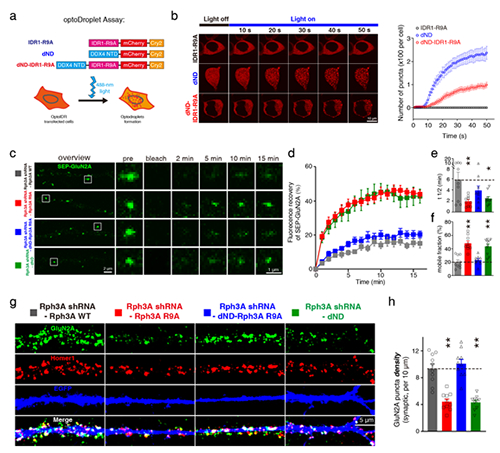
图 Rabphilin-3A相分离调控NMDA受体GluN2A亚基膜聚集和稳定性
在国家自然科学基金项目(批准号:81925011、92149304)等资助下,首都医科大学基础医学院张晨团队在蛋白相分离影响神经元N-甲基-D-天冬氨酸(NMDA)受体膜聚集的机制研究方面取得进展,研究成果以“Rab亲和蛋白3A通过相分离调控NMDA受体2A亚基的流动性和膜表面聚集(Rabphilin-3A undergoes phase separation to regulate GluN2A mobility and surface clustering)”为题,于2023年1月24日在《自然•通讯》(Nature Communications)杂志上在线发表。论文链接:https://www.nature.com/articles/s41467-023-36046-6。
NMDA受体是中枢神经系统中重要的神经递质受体,对于神经元的兴奋性突触传递和突触可塑性十分重要。NMDA受体不同亚基组成决定了其生物物理学和药理学性质以及NMDA受体功能。其中NMDA受体2A(GluN2A)和2B(GluN2B)亚基在神经元可塑性和多种神经疾病,如帕金森病、亨廷顿病、脑卒中中发挥着不同作用。GluN2A和GluN2B在神经元膜表面具有不同的分布特征,迄今为止,不同亚基组成的NMDA受体膜表面聚集的调控机制仍不清楚。
该研究发现Rab亲和蛋白3A(Rabphilin-3A)作为GluN2A特异性的结合蛋白,能够通过其氮末端的精氨酸富集区域发生液-液相分离形成液滴,进而通过与GluN2A的碳末端相互作用募集GluN2A。Rabphilin-3A与GluN2A以及突触后致密蛋白95(PSD95)的相互作用可以促进Rabphilin-3A的相分离。在神经元中破坏Rabphilin-3A的相分离会显著降低GluN2A突触和非突触部位的膜表面聚集,减少GluN2A的突触定位,降低GluN2A的膜表面稳定性和GluN2A依赖的兴奋性突触传递,而对GluN2B在突触部位的聚集和稳定性则没有影响。恢复Rabphilin-3A的相分离特性后则可以挽救上述GluN2A异常变化(图)。
该研究阐明了蛋白相分离对GluN2A亚基在神经元膜表面的分布和稳定的调控机制,对于NMDA受体膜聚集调控机制的研究具有重要意义,对于中枢神经系统疾病的治疗具有潜在的应用价值。
转自:国家自然科学基因委员会
原文链接:
https://www.nsfc.gov.cn/publish/portal0/tab448/info88535.htm
