我国学者在慢性缺血性脑白质损伤的病理生理机制研究方面取得进展
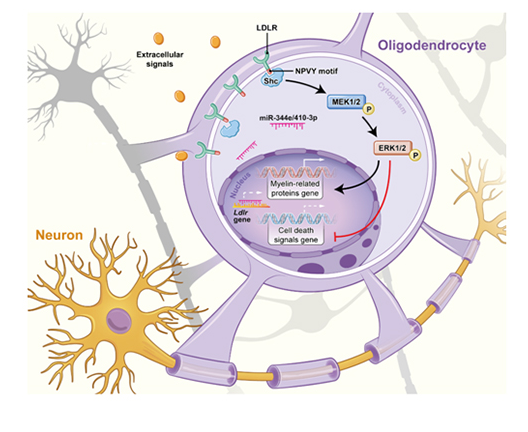
图. 少突胶质细胞LDLR参与细胞髓鞘化的分子机制
在国家自然科学基金项目(批准号:81701180、81901248、81471182)等资助下,南京大学医学院附属金陵医院神经内科叶瑞东、刘新峰团队在少突胶质细胞层面揭示了慢性缺血性脑白质损伤的分子机制,解析了低密度脂蛋白受体(low-density lipoprotein receptor, LDLR)介导的信号转导功能在中枢神经系统缺血性脱髓鞘中的作用,研究成果以“异常的少突胶质细胞LDL受体介导慢性脑缺血性脱髓鞘损伤(Aberrant oligodendroglial LDL receptor orchestrates demyelination in chronic cerebral ischemia)”为题,于2020年11月3日在线发表于《临床研究杂志》(Journal of Clinical Investigation)杂志,论文链接:https://www.jci.org/articles/view/128114。
少突胶质细胞作为脑组织中唯一能够形成髓鞘的细胞,极易受到缺血缺氧性损伤。少突胶质细胞损伤引起的髓鞘脱失会导致患者出现感觉运动功能障碍和神经行为学改变。然而,现阶段相关的机制研究多集中在氧化应激、炎症和兴奋性毒性等方面,尚缺乏细胞特异性的病理生理机制的探讨。LDLR作为少突胶质细胞膜表面重要的功能蛋白,其功能研究多集中在对细胞外胆固醇的摄取方面,而对缺血性髓鞘损伤相关的机制尚不清楚。
为解决上述问题,该团队首先通过建立体内外慢性缺血模型,确定了LDLR在脑白质髓鞘结构中的重要地位,证实了LDLR对于缺血相关髓鞘脱失的改善作用。为了解析其分子机制,该团队明确了调控LDLR的上游分子miR-344e-3p,同时在脑白质疏松患者体内发现了其同源分子miR-410-3p的升高。进一步的研究表明,少突胶质细胞内源性miR-344e/410-3p能够抑制LDLR的表达,LDLR可通过氨基酸序列NPVY元件-Shc蛋白的交互作用抑制少突胶质细胞的死亡,促进髓鞘相关蛋白的表达,从而起到保护脑白质的作用(图1)。而在慢性缺血过程中,miR-344e/410-3p的增多会特异性地导致LDLR的异常减少及NPVY-Shc交互作用的缺失,从而诱发脑白质脱髓鞘损伤。
该研究不仅阐释了缺血相关脱髓鞘损伤的细胞特异性分子机制,同时也补充了LDLR的信号转导作用,为慢性缺血性脑白质损伤的防治提供了新的思路。
转自:国家自然科学基因委员会
原文链接:
http://www.nsfc.gov.cn/publish/portal0/tab448/info79207.htm
