我国学者在代谢性心脏病研究领域取得新进展
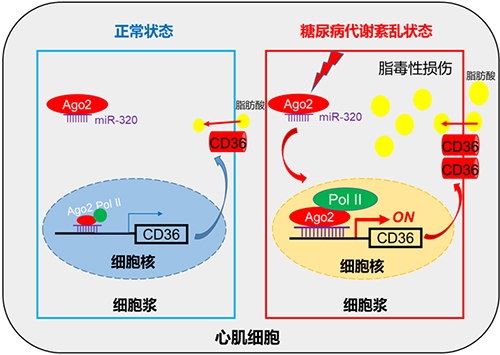
图. 正常状态下,心肌细胞miR-320主要定位于胞浆中,仅少量进入细胞核发挥作用(左图)。糖尿病糖脂代谢紊乱时,心肌细胞中miR-320表达显著增高,在包浆中成熟的miR-320进入细胞核与Ago2和pol II形成复合体促进CD36表达(右图),后者作为脂质转运体促进脂质转运至心肌细胞沉积而致脂质中毒及细胞凋亡,最终导致糖尿病心肌病
在国家自然科学基金项目(批准号:81822002,31800973)等资助下,华中科技大学同济医学院附属同济医院汪道文研究团队在代谢性心脏病研究领域取得重要进展。相关研究成果以“Nuclear miR-320 Mediates Diabetes-induced Cardiac Dysfunction by Activating Transcription of Fatty Acid Metabolic Genes to Cause Lipotoxicity in the Heart”(核miR-320通过激活脂肪酸代谢基因转录导致心脏脂毒性损伤引起糖尿病心功能障碍)为题,于2019年10月22日在线发表在
Circulation Research(《循环研究》)上。华中科技大学李华萍、樊佳慧和赵艳茹为共同第一作者,陈琛和汪道文是共同通讯作者。论文链接:https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.119.314898。
糖尿病患者通常伴有心血管系统并发症,这也是糖尿病患者死亡的主要原因。以往多认为糖尿病通过影响内皮细胞功能导致血管功能障碍和冠心病,然而糖尿病导致心力衰竭几率是非糖尿病者的3倍以上,但对其导致心肌细胞功能障碍及其机制知之甚少。该研究团队首先通过高通量测序和芯片等技术在临床患者样本和多种模式动物中筛查出心脏miR-320表达增高与糖尿病心功能损伤密切相关。同时发现心脏特异性高表达miR-320会加重糖尿病db/db小鼠的心脏功能损伤,而抑制心脏中miR-320的表达可以减轻糖尿病小鼠的心功能损伤。该研究团队利用ChIP-seq等技术进一步研究发现,miR-320在细胞核中促进Ago与RNA聚合酶II结合,进而促进CD36基因的转录;显著高表达的CD36促进心肌细胞摄取过多的中性脂肪酸,从而引起心脏的脂质毒性、促进心肌细胞凋亡,损伤心功能而致糖尿病心肌病形成。
该研究以临床问题为导向,揭示了糖尿病心功能障碍形成的新机制,为糖尿病心肌病的防治提供了药物干预靶点。
转自:国家自然科学基因委员会
原文链接:
http://www.nsfc.gov.cn/publish/portal0/tab448/info76545.htm