我国学者在细胞外基质调控血管稳态与重构方面取得进展
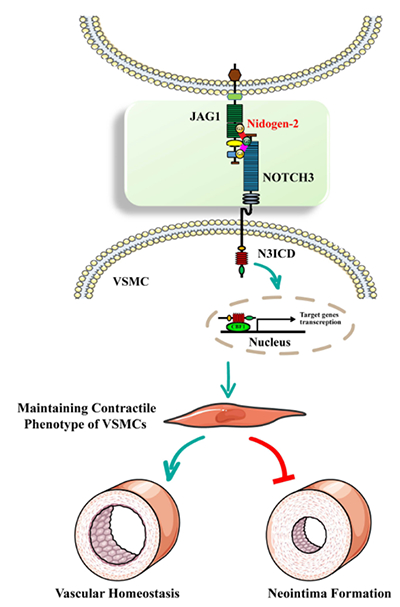
图1 NID2-JAG1-Notch3信号转导通路维持血管平滑肌细胞稳态
在国家自然科学基金项目(批准号:81730010、81921001、31930056、91539203)等资助下,北京大学医学部孔炜教授研究团队在细胞外基质调控血管平滑肌细胞(VSMCs)表型转化机制方面取得新进展,研究成果以“Nidogen-2通过调控Jagged1-Notch3信号维持血管平滑肌细胞收缩表型并抑制血管损伤后新生内膜形成(Nidogen-2 Maintains the Contractile Phenotype of Vascular Smooth Muscle Cells and Prevents Neointima Formation via Bridging Jagged1-Notch3 Signaling)”为题,于2021年7月28日在《循环》(Circulation)杂志上在线发表。论文链接: https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.053361。
VSMCs的表型转化是发生在动脉粥样硬化、血管再狭窄等心血管疾病早期的关键病理过程。探究维持VSMCs收缩表型的相关分子和信号通路对于血管重塑性疾病的治疗具有重要意义。该研究通过构建细胞外基质与VSMCs表型相关基因数据集(VSMCPRG)的蛋白质-蛋白质相互作用网络,发现了一种新的维持 VSMCs收缩表型的胞外基质成份——基底膜基质糖蛋白Nidogen-2。
研究团队利用人颈动脉内膜剥脱组织和导丝拉伤诱导内膜新生的动物模型证实,在血管动脉粥样硬化小鼠血管损伤后再狭窄时Nidogen-2表达下降。基底膜蛋白Nidogen-2基因敲除小鼠血管损伤后内膜增生加重,提示Nidogen-2能显著抑制血管损伤后的新生内膜形成。进一步的生物信息学分析、免疫共沉淀和荧光素酶分析等一系列工作揭示Nidogen-2特异性结合Notch3及其配体 Jagged1。Nidogen-2增强了 Jagged1和 Notch3 的相互作用并放大下游信号,从而维持VSMCs的收缩表型并抑制后续血管损伤后的新生内膜形成。相反,Nidogen-2 缺陷的 VSMCs,Jagged1与Notch3 相互作用及信号转导受损,VSMCs发生表型转化,血管损伤后内膜增生加重(图1)。该研究揭示了基底膜蛋白Nidogen-2对JAG1-Notch3信号的重要调控作用,及其在维持VSMCs收缩表型和血管重塑中的关键作用。研究团队对NID2-JAG1-Notch3相互作用的发现加深了对细胞外基质蛋白如何影响细胞行为的理解,为治疗内膜增生相关的心血管疾病提供了潜在靶点。
转自:国家自然科学基因委员会
原文链接:
http://www.nsfc.gov.cn/publish/portal0/tab448/info81580.htm