蛋白质泛素化与血管病变
正常细胞蛋白质代谢是一个持续降解和再合成的动态过程,维持蛋白质代谢稳态是保持细胞蛋白质正常功能的关键过程。由于基因组编码大量蛋白,而在一定时期内仅有部分蛋白被用于维持细胞功能,正常细胞内累积大量的蛋白代谢产物,包括有待清除、降解及循环再利用的错误折叠蛋白和氧化蛋白,因此严密控制蛋白分子合成、转运和降解的调节系统是机体不可或缺的。真核生物的蛋白降解主要依赖泛素-蛋白酶体系统( ubiquitin proteasome system, UPS),这一系统在维持蛋白质代谢稳态中起中心作用。蛋白质翻译后修饰过程包括泛素化、乙酰化、甲基化、烃化、糖基化、羟基化以及亚硝基化等。这些翻译后修饰是维持蛋白质代谢稳态所必需的,当此过程受到干扰时将导致机体的病理性改变。由于泛素化是细胞分化、凋亡、DNA修复、应激反应、免疫应答等生理过程所必需的,UPS功能异常则介导多种疾病的病理变化,其中包括心血管疾病。近年来越来越多的研究表明UPS在心血管系统生理过程和病理变化中的作用至关重要。
一、
泛素-蛋白酶体系统的基本组成
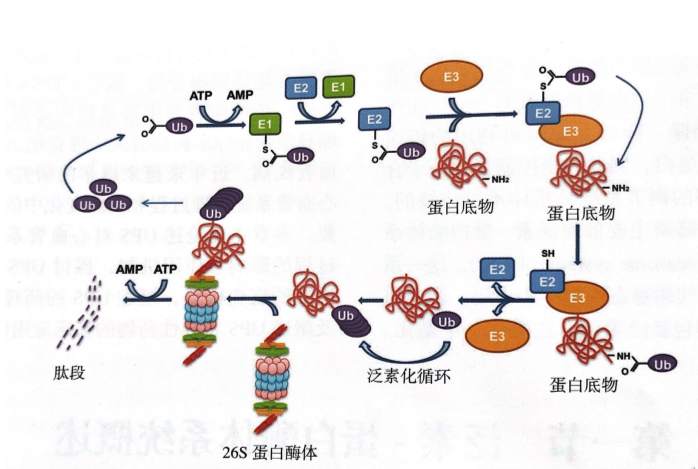
UPS是介导细胞内非溶酶体性蛋白降解的主要系统,可降解短寿蛋白和调节蛋白。介导这一过程的组分包含泛素、泛素启动酶系统和蛋白酶体系统。泛素启动酶系统可活化泛素,并将其结合到待降解的蛋白上,形成靶蛋白多聚泛素链,完成泛素化过程。蛋白酶体系统则识别已泛素化的蛋白并将其降解。细胞内还存在另一类去泛素化蛋白酶( deubuiqitinatingenzyme, DUB ),发挥去泛素化的反向调节作用,解离泛素链分子。UPS对蛋白质的降解由连续的两步组成:①泛素分子与靶蛋白的共价结合;②多聚泛素化的蛋白被26S蛋白酶体降解,同时泛素分子被重新活化。UPS通过泛素分子与蛋白底物的结合标记蛋白酶体所降解的靶蛋白。泛素是一个由76个氨基酸组成的高度保守的多肽链。在ATP的参与下,泛素激活酶(E1)活化泛素并将其转移到泛素交联酶(E2)上,活化的泛素再从E2转移到泛素连接酶( E3 ),与蛋白底物特异性结合的E3催化泛素与蛋白底物活化的赖氨酸残基共价结合。单个泛素分子结合底物蛋白称为单泛素化,单泛素化底物可进一步 被多次泛素化,即多个活化的泛素分子与蛋白底物赖氨酸残基结合,形成多聚泛素链(图1)。泛素结合域或去泛素化酶对多聚泛素链的特异性识别取决于相连泛素分子间的精确结合位点。泛素系统存在严格的分级结构,修饰活化反诉的E1仅有一种结构,而人类基因编码超过20种E2和千余种E3。
图1 蛋白酶体依赖性的蛋白水解:蛋白底物多聚泛素化过程
首先,Ub与E1结合,形成高能硫脂键,使Ub活化;而后通过转脂作用,Ub从E1转移到E2s上;活化的Ub再从E2s转移到E3s,并与底物结合,形成底物-E3s复合物,使底物发生Ub化。蛋白被多聚泛素化后才可被蛋白酶体识别降解。
二、
泛素-蛋白酶体系统与血管内皮细胞功能
UPS通过对底物蛋白特异性的翻译后修饰以及对泛素化靶蛋白的水解,在细胞蛋白质合成降解过程中起中心调节和桥梁作用。因此当这一体系功能异常或作用被干扰时,将会引起细胞的病理变化,从而直接或间接参与机体疾病的病理过程。UPS在心血管系统疾病中同样起着非常关键的作用。新近研究指出UPS在维持内皮生理功能及心血管系统的运转中起重要作用。
(一)
泛素-蛋白酶体与Notch信号
UPS通过调节Notch信号通路影响血管网的生成。Nie等[3]的研究指出Numb蛋白配体X ( ligand of Numb-protein X, LnX )是环指类型的泛素连接酶E3,LNX基因异位突变促进转化生长因子β (transforming growthfactor B,TGFB )诱导的E-钙黏蛋白表达下调,波形蛋白的表达增加,细胞外基质的蓄积及HK2细胞的迁移。作为泛素连接酶E3, LNX可泛素化和降解Numb蛋白,维持Notch通路的信号转导。Numb作为泛素化底物其跨膜受体蛋白PTB结构域可被LNX识别并与LNX PDZ结构域特异性结合。泛素蛋白连接酶FBW7/Sel10也可靶向标记Notch,促进其蛋白酶依赖性的水解。TsunematsuR等在FBW7敲除胚胎主动脉旁胚脏壁外植体培养的体外实验中发现,FBW7基因敲除抑制血管网生成。因此,UPS至少存在两种不同的方式调节Notch通路的信号转导(图2 )。
(二)
泛素-蛋白酶体与NO信号
一氧化氮( nitric oxide, NO )及控制其合成的一氧化氮合酶( nitric oxide synthase, NOS )是维持内皮细胞( endothelial cell, EC)) 正常功能的重要基础物质。NO的生物半衰期十分短暂,调节其生物活性的NOS有三种亚型:内皮型NOS ( endothelial NOS, eNOS )、诱导型NOS(inducibleNOS,iNOS)和神经元型NOS(neuronalNOS,nNOS)。eNOS在内皮细胞为组成型表达,依赖钙离子的参与产生少量NO。内皮细胞eNOS的调节存在至少五种不同的机制,包括:①转录调节;②蛋白翻译后修饰;③与蛋白相互作用,如与Hsp90和窖蛋白;④辅助因子可用度[如四氢生物蝶呤( BH4) ];⑤磷酸化和去磷酸化。UPS通过对NOS的翻译后修饰以及降解,从而调节NO生成的详细机制的研究尚处于初期(图2 )。
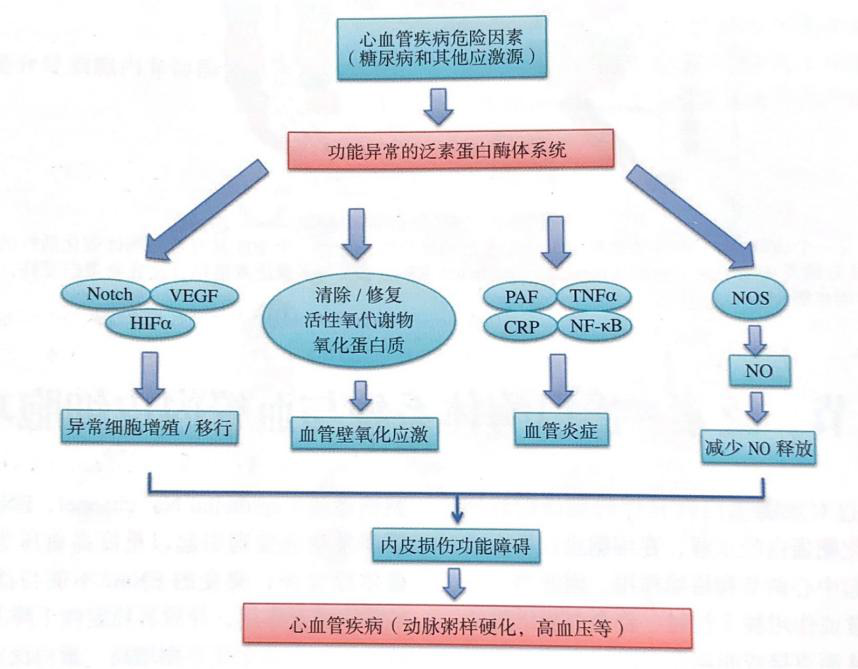
图2 UPS在内皮代谢应激到失代偿性血管疾病过程中的中心性作用
功能异常的UPS通过增加血管张力引起高血压,以及诱导内皮的炎症反应、内膜的氧化应激和血管的发育异常。这些级联反应导致内皮功能障碍和最终的动脉粥样硬化、缺血及梗死形成等。
(三)
泛素-蛋白酶体调节血管炎症
已有报道阐述了UPS如何调节血管炎症反应中特异性组分,进而影响动脉粥样硬化的进程。(1)对调节性T细胞的调节:UPS通过改变调节性T细胞的功能抑制动脉粥样硬化形成中的炎症与免疫反应。氧化型低密度脂蛋白( oxidized low density lipoprotein,oxLDL )或尿毒症患者血清作用于调节性T细胞,降低其蛋白酶体活性,最终导致细胞周期停滞和细胞凋亡。这一临床研究显示终末期肾病血液透析患者外周血中CD4/CD25*Treg细胞数量减少,其免疫抑制功能也相应减低。(2)对巨噬细胞的调节:蛋白酶体抑制剂还可降低内毒素诱导的基因表达,如Toll样受体2,以及抑制LPS诱导的炎症反应。(3)蛋白酶体活性与炎性介质的表达:TNFa诱导炎症和免疫反应部分是通过激活NF-kB。研究发现受试者颈动脉斑块中蛋白泛素化和20S蛋白酶体的活性与TNFa和NF-KB的表达相关,抑制蛋白酶体活性将导致血管炎症加重及重度粥样斑块形成。
(四)
泛素-蛋白酶体与血管功能调控
UPS通过调节血管活性因子在血管功能调控中起重要作用。内皮依赖性舒张因子( endothelium-dependent relaxing factor, EDRF )和内皮依赖性收缩因子( endothelium dependent contractingfactor,EDCF)主要通过内皮细胞调节血管舒张和收缩功能。内皮功能失调时,EDRF水平降低伴随EDCF水平增高,导致基础血管张力增加,引起机体血压升高。内皮素1( endothelin 1,ET1 )和血管紧张素( angiotensin, Ang ) II 是促血管平滑肌收缩作用极强的血管活性肽,UPS则通过调节这些活性肽及其受体和受体相关的信号分子表达,调控血管功能。
大部分血管活性因子,如AngII 和ET1通过与内皮细胞表面特异性G蛋白偶联受体( G-protein coupled reepor, GPCR )结合发挥作用。GPCR及下游的信号通路中存在多个泛素化调节位点。研究证明蛋白酶体参与GPCR降解调控其表达。GPCR又可促进1, 4,5-三磷酸肌醇受体泛素化,介导其经内质网相关蛋白降解( endoplasmic reticulum associated degradation,ERAD )途径快速蛋白水解。GPCR泛素化参与调节GPCR的细胞内吞及其经溶酶体途径的降解。
(五)泛素-蛋白酶体与血管氧化应激
诸多证据表明活性氧自由基( reactiveoxygen species, ROS )参与内皮功能障碍的病理改变。内皮功能障碍的机制之一为 内皮细胞活性氧自由基生成过多和抗氧化机制失效。这种代谢失衡也见于血管壁的其他细胞,包括平滑肌细胞。 一些研究中得到证实。UPS和氧化应激间的相互作用在血管病理生理中起重要作用。蛋白酶体抑制剂可引起内皮细胞的应激反应,提升内皮抗氧化能力,长时间作用于细胞可能产生有害作用,甚至加剧内皮细胞的氧化应激。
三、泛素-蛋白酶体系统有望成为多种血管疾病的治疗靶标
鉴于UPS对人类多种血管疾病如高血压和动脉粥样硬化存在广泛的影响,调控UPS的功能可能成为这些疾病的治疗措施之一。UPS不仅在调节内皮正常生理功能中起重要作用,而且在介导内皮功能失调中的作用也极为关键。大量证据表明UPS参与调节动脉粥样硬化初始期、进展期和终末期(或复合病变阶段)病变的发展。就调节内皮功能而言,抑制UPS显示出预期的收益(如上调eNOS表达和促进eNOS解偶联),可能利于高血压性疾病血压的控制。
(一)蛋白酶体作为治疗靶标的缺点
当前的研究显示抑制UPS获益的同时也可能产生不良效应。(1)基于细胞系的研究显示抑制蛋白酶体可起促炎作用(如在神经元细胞通过抑制COX2降解促进炎症反应)、促凋亡作用及抗炎作用(如在HeLa细胞抑制炎症反应)。(2)这些抑制剂在疾病的不同时期或对不同程度的病变所起的作用不同(如硼替佐米在多发性骨髓瘤治疗中的不同作用)。(3)绝大部分抑制剂在阻断蛋白酶体途径时缺乏特异性(如肽醛、MG132、MG115和PSI ),尽管其对蛋白酶体复合物糜蛋白酶样活性的抑制作用很强,但却存在可逆性及低选择性。
(二)泛素-蛋白酶体系统在血管疾病中尚未阐明及亟待解决的问题
近年来,蛋白酶体标记底物蛋白的各种降解信号被称为降解决定子( degron )。当前的研究指出泛素连接酶通过识别位于蛋白底物上的结构基序或降解信号(降解决定子)特异性作用于靶蛋白。真核蛋白氨基端-降解决定子信号由3部分组成:①一个不稳定的N末端残基;②位于其内部与多聚泛素链结合的酪氨酸残基;③连接这些组分的结构区域。尽管关于UPS识别底物蛋白原理的研究众多,但仍存在一些尚待解答的基本问题。对于上述问题的解答需要全面深人地理解UPS如何介导和调节庞杂的生理信号,参与机体的正常机能和病理改变。
(摘自《血管生物学》第2版)