核受体与血管病变
糖脂代谢紊乱及其所致的应激和炎症反应是多种血管疾病的危险因素和共同病理生理基础。核受体作为一类转录因子超家族,通过调节复杂的基因表达谱构成了机体代谢通路、炎症及众多其他生理及病理过程调控网络的若干重要节点。近年研究表明,多种内、外源物质及其代谢产物作为核受体的配体所组成的调节环路对于维持细胞的代谢稳态具有关键作用。一方面,由于对糖脂代谢紊乱的调节作用,多种核受体的合成配体已经成为糖尿病及脂质紊乱的治疗药物应用于代谢性血管疾病的临床治疗。另一方面,组织特异性基因敲除及转基因、高通量基因组学等研究手段的使用正逐步加深我们对于核受体血管生物学功能的了解,从而有助于阐明血管的生理调节、血管疾病的病理机制以及发现新的治疗靶点和干预策略。
一、
核受体
核受体( nuclear receptor, NR )是一类配体依赖的转录因子,其成员众多,构成了核受体转录因子超家族( nuclear receptor and transcription factor superfamily )。核受体的共同特点是以亲脂性的小分子物质为配体而激活,进而转录调控基因的表达。迄今为止,这一超家族在人类基因组中有48个成员。按照序列比对及构建分子系统发育树可将人类核受体超家族成员分为六个亚家族以及缺乏DNA结合域无法归人以上亚家族的DAX1和SHP。核受体参与机体多种生理功能的调节,如形态发育、细胞增殖分化、炎症及高级神经功能控制等。核受体功能及其所调控的靶基因表达的紊乱参与动脉粥样硬化、糖尿病、肥胖、脂肪肝、肿瘤等重大疾病的病理、生理过程, 也是以上疾病治疗的重要靶点。
(一)
核受体的结构
核受体有共同的结构,它的典型结构分为以下主要功能结构域(图1):①AB区:位于氨 基端,包含配体非依赖性转录激活域( AFI );②C 区: DNA结合区( DNA binding domain, DBD), 包含 两个高度保守的锌指结构用: CX2CX13CX2C (锌指I )和CX5CX9CX2C (锌指II )。DBD介导核受体与其靶基因调节区对应的DNA序列激素反应元件( hormone responsive element, HRE )的结合;③D区:为位于A/B区与C区间的绞链区,使得DBD得以通过旋转发生构像改变,该区也含有核定位信号序列,决定核受体的亚细胞转运 及定位;④E区:即配体结合区( ligand binding domain, LBD ),目前配体激活型核受体的晶体结构均已解明。其主要结构包括与伴侣核受体(如 RXR )形成二聚体的结构界面、与特异亲脂性小分子结合的配体结合袋(ligand-bindingpocket) 以及配体依赖性转录激活域( AF2 )。AF2的核心结构是脂-水双亲性a螺旋,该结构除具有配体依赖性转录激活功能外也负责共激活因子(Co-activator)的征募。⑤F区:位于羧基端,不同核受体间F区序列差异较大。
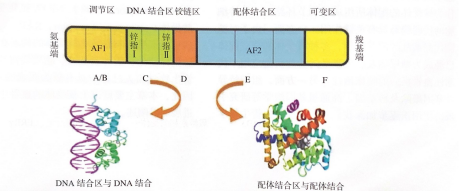 图1核受体结构示意图
图1核受体结构示意图
(二)核受体的配体
配体是指能够与核受体配体结合袋发生可逆性结合的化合物。所有的核受体配体都是亲脂性小分子。由于配体的化学结构、受体选择性以及组织特异性等不同因素,核受体的不同配体会表现出激活或拮抗等多种复杂的作用。
(三)核受体的作用方式
在非配体结合状态下,核受体可存在于胞浆(I型)或核内(I型)。甾类激素等亲脂性小分子配体扩散透过细胞膜与位于细胞质或细胞核的核受体结合后,引起受体构象的改变,引发包括受体二聚体形成、DNA结合、共抑制因子解离及共激活因子复合物形成等一系列的下游级联事件,最终导致基因表达的改变。 核受体转录因子调节基因表达的作用方式较为复杂,根据基础状态下亚细胞定位、二聚体形成方式以及DNA识别序列等的差异大致可分为I型、II型、III型、IV型四种类型。
二、过氧化物酶体增殖物激活受体
过氧化物酶体增殖物激活受体peroxisome proliferator-activated receptor, PPAR )属于核激素受体第一亚家族 ( NRIC )。参与调控糖脂稳态、细胞分化和增殖以及免疫炎症反应等重要细胞生理过程。
PPAR存在三种亚型: PPARa( NR1C1 )、 PPARβ/δ( NR1C2 )和PPARγ( NR1C3 )。PPAR三种亚型分别由不同基因编码,结构、功能各 异。PPAR与视黄酸X受体( retinoic X receptor, RXR )形成异二聚体,结合于靶基因启动子区 的PPAR反应元件( PPAR responsive element,PPRE)。PPRE是由两个AGGTCA半位间隔一个碱基正向重复的HRE ( DR1 )。其激活方式为II型。
参与PPAR转录激活作用的共激活因子主 要有PPAR共激活因子1 ( PPAR co-activator 1, PGC1 )、CREB结合蛋白( CREB binding protein,CBP/P300)、甲状腺激素受体相关蛋白220 thyroid hormone receptor-associated protein 220, TRAP220 )、PPAR结合蛋白( PPAR -binding protein, PBP/PPARBP )等。此外,PPAR 也可以通过蛋白-蛋白相互作用及辅因子竞争作用抑制多种促炎症转录因子的作用,包括核因子-KB ( nuclear factor-KB, NF-KB )、信号转导与转录激活因子( signal transducer and activator of transcription, STAT )、活化蛋白1 ( activator protein 1,AP1 )、活化T细胞核因子(nuclear factor of activated T cells, NFAT )。PPAR 的内源配体主要为多不饱和脂肪酸及前列腺素的衍生物。自发现贝特类调脂药物及噻唑烷二酮类抗糖尿病药物分别激活PPARa及PPARγ以来,PPAR在代谢性心血管疾病中的作用迅速受到关注。针对PPAR的选择性调节小分子也日益成为药物研发的重要靶点。
三、肝X受体的血管生物学作用
肝X受体(Liver X receptor ,LXR)是配体激活别的核受体超家族成员之一。LXR经内源性或合成配体激活后,通过调控其靶基因的转录,参与调节糖、脂代谢、胆固醇转运和炎症等一系列生理和病理生理过程。LXR包括LXRa( NRH3 )和LXRβ( NR1H2 )两种亚型,二者DNA结合域和配体结合域氨基酸序列约有77%的同源性。LXRa大量表达于肝,在巨噬细胞、脂肪组织、肾上腺、肾以及 血管组织中也有少量表达;LXRS则广泛表达于全身各组织中。LXR内源性配体多为氧化固醇类(oxysterol),如22-及27-羟化固醇和124-表氧固醇等。LXR的人工合成激动剂有T0901317和GW3965。LXR与RXR形成异二聚体,通过与靶基因的特定核昔酸序列LXR反应元件E(LXRE,DR4)结合而调节靶基因的转录。此外,LXR活性也受到磷酸化等(如PKA和 PKC )翻译后修饰的调节。
血管内皮LXR表达及活性受到血管部位、血流动力学以及多种生理生化因素的影响。在血管直部如胸主动脉内皮中LXR表达较高。体外培养内皮细胞中层流剪应力上调LXR及其靶基因表达。氧化LDL则降低LXR及其靶基因ABCA1的表达。LXR激动剂抑制内皮细胞促炎黏附分子(VCAMI及ICAM1)、细胞因子(IL6)表达并抑制游离脂肪酸诱导的细胞凋亡等脂毒性反应。血管SMC表达LXRβ及少量LXRa。LXR 激动剂抑制Ang II诱导的SMC增殖及分泌表型。LXR也具有上调LIM1及P27kip表达、抑制血管损伤后内膜新生的作用。LXR激动剂具有降低AngII受体表达、抑制AngII诱导的血管收缩及血压增高的作用。LXR通过直接或间接的方式调控肝脂肪合成的基因表达,如增加固醇应答元件蛋白lc ( SREBP1c )、脂肪酸合酶( fatty acid synthase, FAS )、硬酯酰辅酶A去饱和酶1 ( stearoyl-CoA desaturase1, SCD1)、乙酰辅酶A羧化酶1 ( acyI-CoA carboxylase, ACC )等促脂肪合成基因的表达。尽管LXR合成激动剂( T0901317及 GW3965 )在小鼠模型除减少动脉粥样硬化的发生外也降低血浆胆固醇水平,而且在肥胖小鼠中也具有改善糖耐量的作用,但是,这两种激动剂均升高血浆及肝甘油三酯含量,因此严重限制了其临床应用前景。
四、雌激素受体的血管生物学作用
雌激素通过与雌激素受体( estrogen receptorER)结合调节靶组织的功能。2不同的亚型在结构上有高度的同源性,但在编码基因、组织分布和各组织成分中的表达明显不同,与配体结合后的生物学效应也不同。ERa在女性生殖组织中高表达,如子宫内膜、乳腺、卵巢,在下丘脑也有表达。而ERS在人体各组织中广泛表达,包括中枢神经系统、心血管系统、免疫系统、泌尿道、胃肠道、肾和师。此外,近年来发现的一种 G蛋白偶联受体GPCR30( Rhodopsin 家族)可能是雌激素的第三类受体。
ER作为核受体第三亚家族成员,以I型方式激活。雕激素与ER结合后,与HSP解离,受体以ERa-a、ERBB或ERa.-B的形式发生二聚化后结合于靶基因调控区的雕激素反应 元件( estrogen response elements, ERE) 序列 ( GGTCANNNTGACCT)激动剂或拮抗剂的结合使ER发生相应的构象变化,激活或抑制靶基因转录。此外,ER也通过与其他转录因子如API及SP1等相互作用而调节基因转录。雌激素不仅影响性发育和生殖生理,在心血管系统也有很重要的作用。
在人和动物模型中,雌激素(雕二醇,E2 )调控乙酰胆碱和血流引起的血管舒张作用。在去卵巢自发性高血压雌性大鼠中,乙酰胆碱诱导主动脉内皮依赖性血管扩张明显减弱,但雌激索可以显著增强其血管扩张。在内皮细胞中,E2通 过增加内皮中NO和前列环素( PGI )的产生以预防早期动脉粥样硬化。E2通过上调eNOS表达水平等途径增加NO产生,同时也通过减少内皮细胞超氧阴离子的产生改善NO的生物利用 度。E2也增加内皮细胞前列环素( PGI )的产生,下调缩血管因子内皮素1及AngI受体1的表达等抑制血管收缩反应。雌激素对于凝血功能的影响较为复杂。可能对静脉血栓及动脉血栓的形成有不同作用。实验表明E2可影响血小板数目以及聚集、黏附。这些作用可能与ERβ介导的非基因组作用有关。
五、糖皮质激素受体的血管生物学作用
糖皮质激素或皮质类固醇( glucocorticoids,GC)因其调节葡萄糖( glucose) 代谢、由肾上腺皮质合成( cortex)、具有类似胆固醇的化学结构( steroid) 而得名。糖皮质激素受体( gucocorticoid reepor ;GR )是1985年克隆的第一个留类激素受体基因。GR 广泛表达于各种组织,介导糖皮质激素在机体内分泌稳态、代谢、生长发育、应激反应及免疫功能等多种生理过程的调节效应。人类GR是由位于五号染色体的NR3CI基因编码,具有77个氨基酸。
GC的主要生物作用包括代谢调节、抗炎及免疫抑制等,主要通过激活GR来实现。糖皮质激素是GR的天然配体。在人类 主要为皮质醇( Cortisol),啮齿类为皮质酮(Coricsterone)。GC合成激动剂与GC结构类似,如强的松、强的松龙、地塞米松、佛考龙(fuocotolon)及布地奈德(budsonide)。而米非司酮(RU486)及环丙氨地孕酮 ( cyroterone )为GR括抗剂。孕丽及脱氢表雄 酮( deydrpapndosicrone DHEA) 也具有指抗剂作用。由于GR具有强大的抗炎作用,GR合成激动剂作为类固醇抗炎药物自半个多世纪以来在炎症性疾病的临床治疗中已得到广泛的应用。
在血管组织中不仅具有GR的表达,从而对循环糖皮质激素发生反应,而且血管局部也有GC合成。因此,GC具有显著的血管生物学作用。在内皮细胞中,GC通过减少NO及PGI的产生抑制血管舒张作用;在SMC, GC增强血管对去甲肾上腺素的收缩反应;由此起到升压作用。GC也具有抗血管新生的作用。由于GC的抗炎作用及抗增殖作用,GC抑制胆固醇诱导的动脉粥样硬化模型中血管的巨噬细胞浸润并减少血管损伤后新生内膜的形成。
六、NR4A孤儿受体的血管生物学作用
人类核受体超家族48个成员中近半数迄今尚未发现与之结合的相应配体,因此称作孤儿核受体( orphan nuclear receptor )。核受体NR4A 亚家族的3个成员Nur77( NR4A1 )、 Nurl(NR4A2)和NOR1(NR4A3)即属于孤儿核受体成员。NR4A的三个成员有着高度同源的氨基酸序列及经典的核受体结构域。它们主要作为配体非依赖性组成型激活的转录因子调节基因表达。翻译后调控是其能对外界快速反应的重要调控机制。三种NR4A受体都会在多种激酶如MAPK、PB3K、Akt及JINK等作用下发生丝氨酸磷酸化。NR4A 受体也均有泛索化修饰位点。多种细胞外刺激因素,包括丝裂原、炎症刺激、细胞因子、肽类激素以及细胞应激都能快速诱导NR4A受体的表达并影响其翻译后修饰。NR4A可以单体和同源二聚体形式结合于靶基因的特定反应元件( NBRE. AAAGGTCA );不同NR4A受体之间也会形成异源二聚体而协同激活基因转录。
NR4A通过调节炎症、增殖、分化和调亡相关的复杂蛋白网络参与动脉粥样硬化发生16虽然在血管系统中NR4A受体基础表达水平比较低,但是NR4A受体家族s个成员均在动脉粥样硬化斑块,特别是巨噬细胞、SMC中以及血管 损伤新生内膜中表达。过表达NR4A这三类受体能降低巨噬细胞炎性细胞因子,趋化因子和清道夫受体 ( SRA 及CD36) 的表达,减少oxLDL的摄取。在内皮细胞中,生长因子、炎症因子及缺氧均可诱导NR4A表达。其中VEGF诱导NORI基因表达涉及PKC、钙动员和钙神经素( caleineurin )多条通路介导。纤溶酶原激 活物抑制剂1 ( PAII )也是NR4A受体在内皮细胞的直接把基因,提示NR4A可能也参与调控纤溶与凝血过程。
七、维A酸受体的生物学作用
维A酸(RA)是维生素A或视黄醇 ( retinol )的衔生物。RA有9-顺(9-cis )及全 反( al-trans )维A酸两种形式,分别与维A酸 受体( retinoic acid receptor, RAR )及视黄酸X 受体( retinoic X receptor. RXR )结合。RAR和RXR分别有α、 β、γ三种亚型。RARα 在机体组织中广泛存在;RARβ和RARγ的表达具有一定的组织特异性。 RXRβ几乎表达在所有组织; RXRα主要表达于 肝、肾、肠道与皮肤: RXRγ则主要在肌肉、脑 及垂体表达。RAR 与RXR形成异源二聚体:而RXR可与核受体亚家族的其他成员如TR、VDR、PPAR、LXR、 FXR、 PXR等形成异源二聚体。RAR及RXR以不同二聚体形式结合于把基因启动子区的RARE ( DR2或者DR5)和RXRE(DR1)元件,配体结合后调节靶基因的转录。维甲酸信号在机体发育以及其他多种细胞增殖、分化、炎症等生理病理过程中具有重要作用。RAR及RXR的合成配体已经广泛用于多种皮肤疾病(银屑病、痤疮、皮肤老化)及肿瘤(白血病)的临床治疗。
大量基础及临床研究提示维A酸在动脉粥样硬化及血管再狭窄等疾病中有重要作用。维A酸调节血管平滑肌细胞的增殖、迁移、分化以及血管炎症反应、纤溶、血栓等病理生理过程。近年研究发现维A酸也沙及血管内皮功能及钙化的调控。维A酸在心血管发育中有重要作用。维A酸对于血管内皮功能的改善可能涉及通过PI3K/AKt激活eNOS,从而增加NO释放。维A酸对于凝血纤落系统的作用以促纤溶抗血栓为主。维A酸以上血管作用大多是通过RAR而非RXR发挥作用。
RXR形成的异源二聚体依据RXR的作用有两种方式,即容许性( prissive)与非容许性 ( non-permissive )二聚体。非容许性二聚体只能由配对核受体如RAR、VDR及TR的配体激活。容许性二聚体既可以被与RXR配对的核受体如 PPAR, LXR、PXR的配体激活,也可以被RXR本身的配体激活,两种配体同时结合可发挥相 加或协同效应。9- 顺维A酸是最早发现的RXR 天然配体。二十二碳六烯酸( docosahexaenoic acid, DHA).油酸( oleic acid).植烷酸 ( phytanic acid )等脂肪酸也是RXR配体。
八、核受体与血管生物节律的调控
生物节律是由内源性生物钟调控的机体生理过程的周期性变化。糖脂代谢、激素(胰岛素、瘦素、皮质醇)分泌、胰岛素敏感性、血压、凝血反应等生理过程均具有昼夜节律性。生理节律异常与代谢紊乱、肥胖、糖尿病、心血管疾病等有着密切联系。生物钟核心机制的简化模式是细胞内两种基因调控蛋白Tim ( timeles )和Per( period )水平的时相性调控。这种基因转录的时相性反馈调节环路构成基因表达时间节律性的基础。已知的核心生物钟基因主要包括Clock ( crcadian locomoor oupu cyeles kaput )及其类似物Npas ( nuronal PAS domain protein 2). Bmall( brain and musle A ARNT:ike pocin1 ); Peiod基因( Perl,. Per2. Per3 ); Cry 基因( eryptochrome 1与cryptochrome 2)等。在哺乳类动物中,位于下 丘脑视上核( suprachiasmatic mucleus, SCN )的昼夜节律起搏点产生主控时钟节律。外周组织和细胞也存在这样的生物节律,其分子生物学机制和视上核的细胞相同,并且外周节律受到中枢时钟的调控。同样,心血管系统也存在这样的生物节律,一些生物钟基因表达的改变参与了心血管系统疾病的发生,如血压、心率等生理现象以及心血管疾病的发作时间都有明显的时间规律等。最近研究表明代谢性核受体与生物节律调控密切相关,不仅核受体表达受到生物钟调节,而且核受体在调节代谢节律方面有重要作用。其中,Rev-Erba( NRIDI )和RORa( NRIFI )作为生物钟核心调节分子在脂质代谢、炎症反应及血管功能方面发挥重要作用。
(摘自《血管生物学》第2版)
